Die meisten Metalle, die der Herstellung unterschiedlichster Erzeugnisse dienen, kommen in der Natur nur in chemischen Verbindungen vor, die als Erze bezeichnet werden. Erst nachdem sie aus diesen Verbindungen freigesetzt sind, stehen sie als Metall zur Verfügung. Lässt man der Natur ihren Lauf, kann sich Korrosion einstellen. Die Materialien reagieren mit Stoffen aus ihrer Umgebung, um in ihren ursprünglichen Zustand zurückzukehren. Lesen Sie, welche Korrosionsarten in Erscheinung treten und wie sich die Widerstandsfähigkeit von Metallwerkstoffen durch Verfahren der Oberflächenbehandlung erhöhen lässt.
Unterscheidungskriterien für Korrosionsarten von Metall
Korrosion beschädigt den Werkstoff. Ohne Gegenmaßnahmen hätte viele Metallerzeugnisse eine sehr kurze Lebensdauer. Geeignete Mittel für den Korrosionsschutz lassen sich nur finden, wenn man die Ursachen und die Wirkungsmechanismen der Korrosionsprozesse berücksichtigt. Die einzelnen Metalle und Legierungen reagieren unterschiedlich auf korrosiven Angriff durch Umgebungsmedien. Bei den Korrosionsarten spielen sowohl die chemischen Elemente als auch das Werkstoffgefüge, das sich beim Erstarren der Schmelze bildet, eine Rolle. Außerdem wirken sich die vorangegangene Metallbearbeitung und die konstruktive Gestaltung auf das Korrosionsverhalten aus. Schließlich ergeben sich Unterschiede in der Ausbreitung der Werkstoffzerstörung, die sich auf die Metalloberflächen oder in die Werkstofftiefe erstrecken kann. Anhand dieser Kriterien unterscheidet man verschiedene Korrosionsarten von Metall, um der Korrosion gezielt entgegenwirken zu können.
Korrosionsarten nach Reaktionsmechanismen
Bildung von Lokalelementen
Ausgangspunkt für die Überlegungen ist der atomare Metallaufbau. Die Atome sind in regelmäßigen Gittern angeordnet. Die äußeren Elektronen der Atomhüllen sind in den Gittern frei beweglich. Ihr Fehlen in den Atomhüllen bewirkt, dass sie positive Ladung der Atomkerne überwiegt. Genaugenommen setzen sich die Gitter deshalb aus Ionen zusammen, die auf elektrische Spannungsfelder reagieren. Wenn Feuchtigkeit vorhanden ist, bilden sich galvanische Elemente. Diese Korrosionsarten entsprechen in ihren Abläufen der galvanischen Beschichtung oder der Elektrolyse von Wasser. Ein geringer Stromfluss bewirkt, dass sich an der Stelle, an der ein Elektronenmangel herrscht (Anode), Metallionen auflösen und mit dem Sauerstoff aus der Feuchtigkeit verbinden. An der Stelle, an der Elektronenüberschuss (Kathode) herrscht, entsteht gasförmiger Wasserstoff, der sich sofort mit dem Luftsauerstoff zu Wasser umsetzt. Die Werkstoffbereiche, in denen solche Vorgänge ablaufen, haben meistens nur eine gering räumliche Ausdehnung. Daraus resultiert die Bezeichnung Lokalelemente.
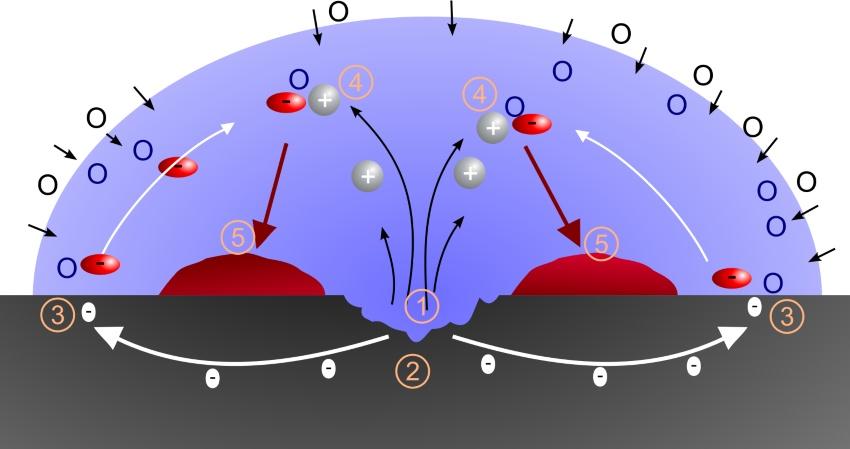
Kontaktkorrosion
Kommen unterschiedliche Metalle miteinander in Kontakt, lässt sich zwischen ihnen ein elektrischer Spannungsunterschied (Potentialunterschied) beobachten. Es bildet sich ein elektrisches Feld aus. Nach der Größe der Spannungsunterschiede sortiert, ergibt sich die elektrochemische Spannungsreihe. In die Mitte wurde willkürlich der Wasserstoff gesetzt. Alles, was im elektrischen Feld positiver ist, gilt als edel. Alles, was im elektrischen Feld negativer ist gilt als unedel. Je weiter die Metalle in der Reihe voneinander entfernt stehen, umso größer ist der Spannungsunterschied und demzufolge auch der Stromfluss, der sich einstellt, wenn sich ein geschlossener Stromkreis ausbildet. Der Strom besteht aus den Ionen des unedleren Metalls, die sich aus ihrem Gitter herauslösen, zum edleren metallischen Stoff wandern und sich dort ablagern. Diese Korrosionsarten lassen sich durch die Verwendung gleicher Materialien in einem System oder durch sorgfältige Isolierung unterdrücken.

Chemische Oxidation
Neben elektrochemischen Prozessen kommen bei gewissen Korrosionsarten auch direkte chemische Reaktionen als Ursache für Korrosion vor. Treten bestimmte trockene Gase, Salze, Laugen oder Säuren mit den Metalloberflächen in Kontakt, bilden sie mit Metallatomen Moleküle, die ihre Stabilität aus der gemeinsamen Nutzung von Elektronen erhalten. Den Ablauf dieser Korrosionsarten bezeichnet man als Redoxreaktionen. Das Metall erhält Elektronen zur Nutzung, es wird oxidiert. Der Reaktionspartner stellt diese Elektronen zur Verfügung. Er wird reduziert. Die Vorgänge laufen verstärkt bei hohen Temperaturen ab. Zu den Stoffen, die ein derartiges Verhalten auslösen, gehören zum Beispiel Sauerstoff, Schwefelwasserstoff, Ammoniak, Chlor und Ammoniumsalze. Diese Arten von Korrosion lassen sich durch den Einsatz beständiger Werkstoffe oder eine geeignete Beschichtung vermeiden.

Biokorrosion
Zu den Korrosionsarten von Metall zählt auch die Biokorrosion. Bei dieser Form der Korrosion stammen die Stoffe, die den korrosiven Angriff ausüben, aus dem Stoffwechsel von Lebewesen. Mikroorganismen, Pilze, Flechten, Pflanzen und Tiere, die sich auf Metalloberflächen ansiedeln, erzeugen ein nahezu unerschöpfliches Repertoire an organischen Stoffen, die mit Metallen chemische Verbindungen bilden können. Dazu zählen viele organischen Säuren, wie zum Beispiel Ameisensäure, Essigsäure, Harnsäure und Zitronensäure. Außerdem können sich Stoffwechselprodukte wie Schwefelwasserstoff und Stickstoffoxide bilden, die sich unter bestimmten Bedingungen mit Wasser zu Schwefel- bzw. Salpetersäure umsetzen.
Korrosionsarten von Metall nach Ausbreitungsmechanismen
Flächenkorrosion
Bei dieser Korrosionsart erfolgt die elektrochemische Umsetzung des Werkstoffs gleichmäßig auf den Metalloberflächen. Je nach eingesetztem Werkstoff bilden sich durch den Einfluss von Luftsauerstoff und Feuchtigkeit schnell dünne Passivschichten, die das darunter liegende Material vor weiterer Zerstörung schützen. Das ist zum Beispiel bei Chrom, Zinn und rostfreiem Edelstahl der Fall. Die Oxidschichten auf vielen Eisenwerkstoffen sind jedoch locker porös. Ohne Korrosionsschutz schreitet die Werkstoffschädigung so lange fort, bis das Material aufgebraucht ist.

Lochfraß
Lochfraß zählt zu den elektrochemischen Korrosionsarten. Er tritt vor allem auf, wenn die passivierenden Schichten auf Metalloberflächen Fehlstellen enthalten. Verstärkt wird die Werkstoffschädigung durch den Einfluss von Chlorid- oder Bromidionen. Sie besetzen die Fehlstellen und verhindern den Zutritt von Sauerstoff, der die Passivschicht wieder reparieren würde. Es bildet sich bei dieser Korrosion zunächst eine punktförmige Werkstoffschädigung, die sich immer weiter in das Grundmetall ausdehnt.

Spaltkorrosion
Enthält eine Metallkonstruktion beispielsweise an überlappenden Kanten, aufgesetzten Bauelementen oder unterbrochenen Schweißnähten enge Spalten, weicht die Konzentration der umgebenden Stoffe im Spalt von der außerhalb des Spaltes ab. Der Konzentrationsunterschied verursacht einen Potenzialunterschied, ähnlich wie er zwischen unterschiedlichen Metallen auftritt. Das führt zu elektrochemischen Reaktionen im Spalt.
Weitere Korrosionsarten von Metall
In Abhängigkeit von der Werkstoffzusammensetzung, dem Werkstoffgefüge, den mechanischen Belastungen während der Metallbearbeitung oder im Betrieb und der Betriebstemperatur werden zahlreiche weitere Korrosionsarten unterschieden. Beispiele sind:
- Interkristalline Korrosion
- Spannungsrisskorrosion
- Schwingungsrisskorrosion
- Unterwanderungskorrosion
- Hochtemperaturkorrosion
- Messerlinienkorrosion
- Erosionskorrosion
- Streustromkorrosion
Zur Vermeidung von Schäden durch diese Korrosionsarten tragen hauptsächlich eine sorgfältige Werkstoffauswahl und die korrosionsschutzgerechte Konstruktion bei.

Korrosionsschutz durch Stoffe und Verfahren der Oberflächentechnik
Korrosionsinhibitoren zum Schutz bei Bearbeitung und Transport
Die Oberflächentechnik stellt Korrosionsinhibitoren zum Schutz vor Korrosion zur Verfügung, die Metallwerkstoffe während der Bearbeitung und beim Transport vor dem korrosiven Angriff durch Umgebungsmedien schützen. Diese Stoffe werden Prozessflüssigkeiten wie Kühlschmierstoffen oder Reinigungsmitteln zugesetzt und Verpackungen beigegeben. Für die Wirkung von Korrosionsinhibitoren existieren zwei Methoden. Einige schützen die Metalloberflächen dadurch, dass sie die gefährdeten Werkstoffbereiche bedecken. Andere reagieren mit den korrosiven Medien und verhindern damit deren Wirkung.
Oberflächenbehandlung zum Schutz von Metallerzeugnissen vor Korrosion
Die am häufigsten auftretenden Korrosionsarten von Metall lassen sich durch eine zweckmäßige Beschichtung unterdrücken. Dafür werden in der Oberflächenbehandlung bzw. der Oberflächenvorbehandlung vielfältige Verfahren eingesetzt.

Beispiele sind:
- Erzeugung von Konversionsschichten (Konversionsverfahren)
- Lackierung
- Pulverbeschichtung
- Galvanisierung
- Verzinkung
Die Beschichtungen verhindern, dass die Umgebungsmedien in Kontakt mit den Metalloberflächen kommen.
 Kluthe Magazin
Kluthe Magazin

