Anodisieren ist die Bezeichnung für elektrochemische Verfahren der Oberflächentechnik, die auf geeigneten Metallen mechanisch und chemisch stabile Oxidschichten hervorbringen. Gleichbedeutend ist der Begriff Eloxieren, der sich aus den Anfangsbuchstaben der Wörter elektrochemisch und Oxid ableitet. Informieren Sie sich hier über den Verfahrensablauf und über die Anwendungsgebiete für die Anodisierung sowie über die Naturgesetze, die dabei wirken.
Kurzer Einblick in die Elektrochemie
Unternehmen Sie mit uns einen kurzen Ausflug in die Elektrochemie, um etwas mehr über die Grundlagen für den Einsatz des Verfahrens in der Oberflächentechnik zu erfahren.
Energiequelle
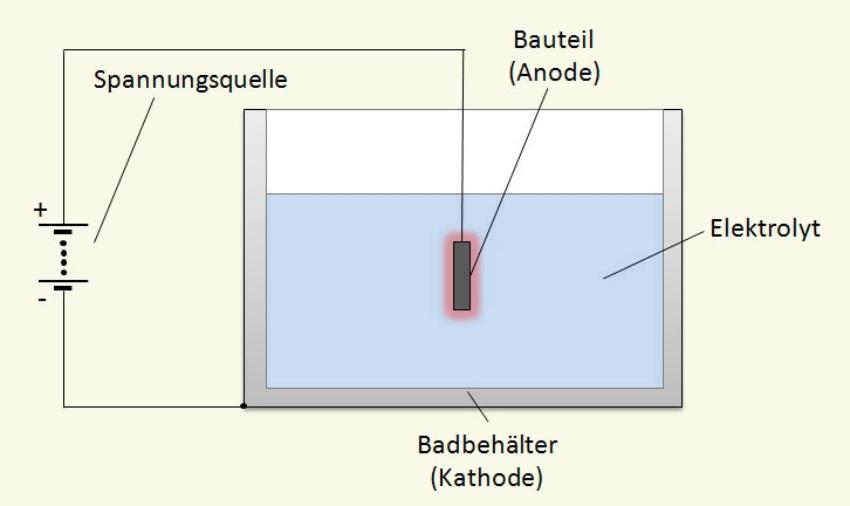
Die Elektrochemie nutzt für die anodische Oxidation meistens Gleichstromquellen. Diese sind durch einen Pluspol und einen Minuspol gekennzeichnet. Am Minuspol herrscht ein Überschuss an negativ geladenen Elektronen. Die Natur will diesen Ladungsunterschied (auch elektrische Spannung, Potenzialunterschied genannt) schnell ausgleichen. Baut ihr der Mensch einen Weg, der durch Lampen, Motoren oder Heizwendeln führt, erhält er Licht, Bewegungsenergie oder Wärme. Und die Natur hat dem Menschen auch einen Weg gezeigt, den Ladungsausgleich in der Oberflächentechnik zu nutzen: elektrochemische Reaktionen.

Elektroden
Elektrisch leitende Verbindungen zwischen den Polen der Gleichstromquelle und zwei räumlich voneinander getrennten Metallgegenständen verwandeln diese Gegenstände in Elektroden. Die mit dem Minuspol verbundene Elektrode nennt sich Katode. Die andere heißt Anode. Bei der anodischen Oxidation ist die Anode das Werkstück, das eine Oxidschicht bekommen soll. Um diese aufzubauen, ist ein Elektrolyt erforderlich, der die Anode umspült und die Katode wenigstens benetzt.
Elektrolyt
Der Elektrolyt für die Anodisierung besteht aus in Wasser aufgelösten Basen (auch Laugen genannt), Säuren oder Salzen. Diese Stoffe sind aus elektrisch positiv und negativ geladenen Ionen zusammengesetzt. Im Wasser sind die Ionen voneinander getrennt frei beweglich. Auf den ersten Blick scheint es, der Elektrolyt könne den Strom leiten. Bei genauer Betrachtung stellt sich jedoch heraus, dass die Ionen zur elektrisch entgegengesetzt geladenen Elektrode wandern und dort Elektronen aufnehmen bzw. abgeben. Die Ionen bewerkstelligen damit einen Ladungsausgleich “in eigener Sache” und wandeln sich die chemisch um.
Chemische Reaktionen
Die Chemie bezeichnet Reaktionen, bei denen Elektronen aufgenommen werden, allgemein als Reduktion. Solche Reaktionen laufen an der Katode ab, an der der Elektronenüberschuss herrscht. Beim Eloxieren entsteht dort in der Mehrzahl der Fälle gasförmiger Wasserstoff.
An der Anode, an der Elektronenmangel besteht, geben Ionen Elektronen ab. Allgemein werden solche Reaktionen als Oxidation bezeichnet. Beim Anodisieren tritt Sauerstoff als Elektronenlieferant in Erscheinung. Er verbindet sich mit dem Elektrodenmaterial zu einem Metalloxid.
Was ist Anodisieren genau? Verfahrensablauf beim Anodisieren
Vorbehandlung als Voraussetzung für eine fehlerlose Schichtbildung
Die Bildung einer gleichmäßigen Oxidschicht durch die Anodisierung ist nur auf metallisch reinen Oberflächen möglich. Deshalb bedarf es einer gründlichen Oberflächenvorbehandlung. Die Oberflächentechnik bietet mechanische und chemische Verfahren, mit denen sämtliche Verunreinigungen von Werkstoffen entfernt werden können.
Mit mechanischen Verfahren der Oberflächentechnik lassen sich fest anhaftende Verschmutzungen und Korrosionsprodukte beseitigen. Außerdem erhalten die Oberflächen eine festgelegte Struktur, wie beispielsweise ein glänzendes oder mattes Erscheinungsbild, wobei auch eventuell vorhandene Kratzer oder Fehlstellen verschwinden. Die mechanische Vorbehandlung erfolgt hauptsächlich durch Bürsten, Strahlen, Schleifen oder Polieren.
Bei der chemischen Vorbehandlung werden in der Oberflächentechnik vor allem Verschmutzungen aus vorangegangenen Arbeitsschritten entfernt. Dabei handelt es sich oft um Öle und Fette, die dem Korrosionsschutz dienten oder um Kühl- und Umformschmierstoffe, die in der Fertigung eingesetzt wurden. Zum Einsatz kommen die Entfettung mit vorwiegend alkalischen Reinigungsmitteln und das Beizen in sauren oder alkalischen Bädern, wobei letzte Reste von Verschmutzungen und die natürliche Oxidschicht von den Oberflächen entfernt werden.

Ablauf der Anodisierung
Einzelne Werkstücke werden für das Anodisieren an Gestellen befestigt und in das Elektrolytbad getaucht. Alternativ dazu lassen sich zu Coils aufgewickelte Bleche durch das Bad ziehen und nach dem Eloxieren wieder zu Coils zusammenwickeln. Eine elektrisch leitende Verbindung zum Pluspol der Gleichstromquelle sorgt dafür, dass der Werkstoff zur Anode wird. Als Katode dient oft das Material des Behälters, in dem der Prozess abläuft. Ist das nicht möglich, werden seitlich an der Behälterwand Katoden angebracht und mit dem Minuspol der Gleichstromquelle verbunden.
Nach dem Eischalten der Stromquelle beginnen die Ionen ihre Wanderung. Dabei bildet sich am Werkstück oder Halbzeug zunächst eine dünne, elektrisch isolierende Schicht aus Metalloxid. Weil die Anode ihre Anziehungskraft beibehält, stauen sich die negativen Ionen vor dieser Schicht. Dadurch steigt die Spannung an bis sie einen Wert erreicht, der es den Ionen ermöglicht, die Schicht bis zum Grundwerkstoff zu durchschlagen, um neues Metalloxid zu bilden. Dieser Vorgang wird häufig von sichtbaren Blitzen begleitet. Am Grundwerksstoff setzt sich die Oxidation fort. Es baut sich eine poröse Schicht auf, die durch sehr viele mikroskopisch kleine Kanäle durchsetzt ist. Beschaffenheit und Aufbau der Oxidschicht lassen sich durch die Zusammensetzung des Elektrolyten sowie die Wahl der Stromstärke und die Einstellung der Temperatur in weiten Grenzen steuern.

Nachbehandlung zum Verschluss der Poren und zur Farbgebung
Die poröse Struktur der frischen Schicht aus Metalloxid eignet sich hervorragend, um Farbstoffe aufzunehmen. Nach dem Einfärben (sofern das gewollt ist, sonst unmittelbar nach dem Eloxieren) müssen die Poren allerdings verschlossen werden. Dieser Vorgang läuft meistens in einem Heißwasserbad ab. Bei einer Temperatur von 97 °C reichert sich das Metalloxid mit Wasser an (Hydratisierung). Dadurch vergrößert sich das Volumen der Schicht und die Poren werden zusammengedrückt. Die Verdichtung wird in der Fachsprache als Sealing bezeichnet. Eine alternative Möglichkeit zum Verschluss der Poren bietet die Oberflächentechnik durch das Verfüllen Wachsen.
Einsatzgebiete des Anodisierens
Die Anodisierung ist ein geeignetes Mittel, auf Leichtmetallen korrosions- und verschleißbeständige Oxidschichten zu erzeugen. Das ist vor allem auf die Eigenschaften der Oxide zurückzuführen. Genutzt wird das Verfahren vor allem für Aluminium, Titan und Magnesium. Wollte man beispielsweise Edelstahl eloxieren, würde das Verfahren nicht funktionieren. Bei diesem Werkstoff beruht der Korrosionsschutz auf einer hauchdünnen Schicht, die das enthaltene Legierungselement Chrom mit dem Luftsauerstoff bildet.
Aluminium anodisieren
Aluminium anodisieren ist die am weitesten verbreitete und am besten erforschte Variante des Eloxierens. Es hat eine eigene Bezeichnung bekommen: Eloxal. Der Einsatz von Aluminium erstreckt sich vom Flug- und Fahrzeugbau über den Maschinen- und Gerätebau bis hin zum Bauwesen und der Architektur.

Titan anodisieren
Titan erweist sich durch seine geringe Dichte, die stark mechanische Festigkeit und die hohe Temperaturbeständigkeit als idealer Werkstoff für die Raumfahrt- und Flugzeugindustrie. Diese Eigenschaften und die hervorragende chemische Beständigkeit sind der Grund für die Chemieindustrie und die Medizintechnik, Titan anodisieren zu lassen.
Magnesium anodisieren
Da Magnesium besonders leicht und dennoch sehr fest ist, rückt es zunehmend in das Interesse des Automobil- und Gerätebaus. Allerdings stellt das Anodisieren von Magnesium eine Herausforderung für die Oberflächentechnik dar. Das Metall ist sehr reaktionsfreudig. Es erfordert eine besondere Herangehensweise sowohl bei der Vorbereitung als auch bei der Durchführung der anodischen Oxidation.
 Kluthe Magazin
Kluthe Magazin
